大腸桿菌感受態(tài)細(xì)胞的制備實(shí)驗(yàn)
01
簡(jiǎn)介
在大腸桿菌感受態(tài)細(xì)胞的制備實(shí)驗(yàn)中,通過(guò)特殊方法(如電擊法或CaCl2法)處理細(xì)胞,使得細(xì)胞膜的通透性暫時(shí)性地發(fā)生改變,從而形成能夠允許外源DNA分子進(jìn)入的細(xì)胞,這些被稱為感受態(tài)細(xì)胞(Component cells)。
大腸桿菌蛋白表達(dá)系統(tǒng)被廣泛應(yīng)用,是經(jīng)濟(jì)實(shí)惠的蛋白表達(dá)系統(tǒng)之一。該系統(tǒng)具有清晰的遺傳背景、快速的細(xì)胞增殖、高表達(dá)量、良好的穩(wěn)定性以及強(qiáng)大的抗污染能力等特點(diǎn),因此適用于多種蛋白的表達(dá)。
02
實(shí)驗(yàn)原理
在大腸桿菌感受態(tài)細(xì)胞的制備實(shí)驗(yàn)中,外源DNA的重組質(zhì)粒在體外組裝完成后,需要引入宿主細(xì)胞中。這個(gè)過(guò)程發(fā)生在細(xì)胞進(jìn)行大規(guī)模復(fù)制和繁殖時(shí),才能獲得純凈的重組質(zhì)粒DNA,這個(gè)過(guò)程稱為轉(zhuǎn)化。通過(guò)一些特殊的方法,如使用CaCl2、RuCl等化學(xué)試劑處理,可以改變受體細(xì)胞的細(xì)胞膜通透性,使其能夠容納外源DNA的載體分子。
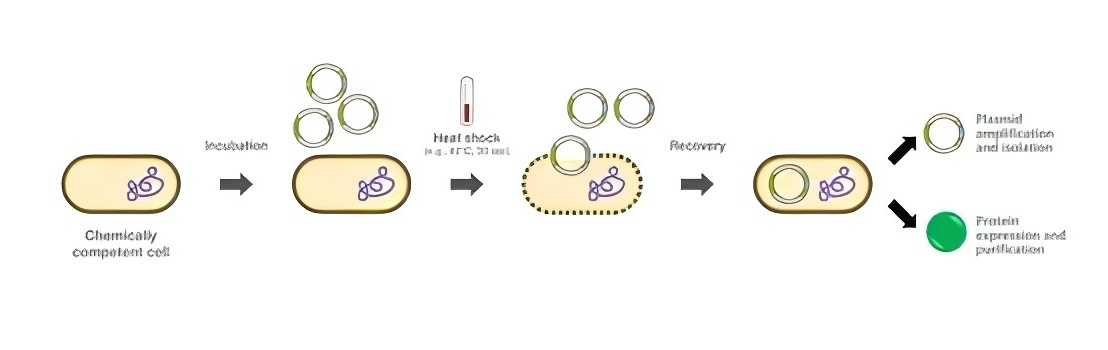
CaCl2法制備感受態(tài)細(xì)胞(圖源網(wǎng)絡(luò))
03
實(shí)驗(yàn)準(zhǔn)備
1.實(shí)驗(yàn)材料、試劑
E. coli DH5α菌株、LB固體培養(yǎng)基、LB液體培養(yǎng)基、CaCl2、硫酸鎂、SOB、TFB。
2.儀器耗材
培養(yǎng)皿、恒溫?fù)u床、聚丙烯管、電熱恒溫培養(yǎng)箱、臺(tái)式高速離心機(jī)、無(wú)菌工作臺(tái)、燒瓶、恒溫水浴鍋、低溫冰箱、制冰機(jī)、分光光度計(jì)、微量移液槍、錐形瓶、試管。
04
實(shí)驗(yàn)步驟
1.從經(jīng)過(guò)37℃培養(yǎng)16-20小時(shí)的培養(yǎng)平板中挑選一個(gè)單獨(dú)的菌落(直徑為2-3毫米),并將其轉(zhuǎn)移到一個(gè)含有100毫升LB或SOB培養(yǎng)基的1升燒瓶中。在37℃下強(qiáng)烈振蕩培養(yǎng)3小時(shí)。根據(jù)一般經(jīng)驗(yàn),1個(gè)OD600(光學(xué)密度為600納米)約相當(dāng)于含有大腸桿菌DH5α 10^9個(gè)/mL。
2.將細(xì)菌轉(zhuǎn)移到一個(gè)經(jīng)過(guò)消毒、只使用一次的、事先用冰冷卻的50毫升聚丙烯管中。將培養(yǎng)物置于冰上靜置10分鐘,使其冷卻至0℃。
3.在4℃條件下,使用Sorvall GS3特制離心頭(或類似的離心頭),以每分鐘4,100轉(zhuǎn)的速度離心10分鐘,以回收細(xì)胞。
4.倒出培養(yǎng)液,將管倒置1分鐘以使最后的痕量培養(yǎng)液流盡。
5.每50毫升的起始培養(yǎng)液使用30毫升預(yù)冷的0.1 mol/L CaCl2-MgCl2 溶液(80 mmol/L MgCl2,20 mmol/L CaCl2)重新懸浮每份細(xì)胞沉淀。
6.于4℃用Sorvall GS3轉(zhuǎn)頭(或與之相當(dāng)?shù)霓D(zhuǎn)頭)以4100 r/min離心10 min,以回收細(xì)胞。
7.倒出培養(yǎng)液,將管倒置1分鐘以使最后的痕量培養(yǎng)液流盡。
8.每50 ml初始培養(yǎng)物用2 ml用冰預(yù)冷的0.1 mol/L CaCl2(或TFB)重懸每份細(xì)胞沉淀。
9.此時(shí),可以用新鮮制備的感受態(tài)細(xì)胞直接做轉(zhuǎn)化實(shí)驗(yàn),也可以將細(xì)胞凍存于-70℃。
05
感受態(tài)細(xì)胞制備及轉(zhuǎn)化中的影響因素
1. 細(xì)胞的生長(zhǎng)狀態(tài)和密度
從-70℃或-20℃甘油保存的菌種中直接轉(zhuǎn)接用于制備感受態(tài)細(xì)胞的菌液。細(xì)胞生長(zhǎng)密度以每毫升培養(yǎng)液中的細(xì)胞數(shù)在5×107個(gè)左右為佳。對(duì)于TG1菌株,當(dāng)OD600為0.5時(shí),細(xì)胞密度在5×107個(gè)/ml左右。受體細(xì)胞一般應(yīng)是限制-修飾系統(tǒng)缺陷的突變株,不含限制性內(nèi)切酶和甲基化酶的突變株。制備出的感受態(tài)細(xì)胞暫時(shí)不用時(shí),可加入占總體積10%-15%的無(wú)菌甘油或-70℃保存。
2. 質(zhì)粒DNA的質(zhì)量和濃度
用于轉(zhuǎn)化的質(zhì)粒DNA應(yīng)為超螺旋態(tài)的,轉(zhuǎn)化率與外源DNA的濃度在一定范圍內(nèi)成正比。加入的外源DNA量過(guò)多或體積過(guò)大會(huì)使轉(zhuǎn)化率下降。DNA溶液的體積不應(yīng)超過(guò)感受態(tài)細(xì)胞體積的5%。質(zhì)粒分子量過(guò)大的轉(zhuǎn)化效率低,大于30kb的重組質(zhì)粒難以進(jìn)行轉(zhuǎn)化。重組DNA分子的構(gòu)型與轉(zhuǎn)化效率密切相關(guān),環(huán)狀重組質(zhì)粒的轉(zhuǎn)化率較線性重組質(zhì)粒高10~100倍。
3. 試劑的質(zhì)量
所用的CaCl2等試劑應(yīng)是最高純度的,并用最純凈的水配制,最好分裝保存于4℃。
4. 防止雜菌和雜DNA的污染
操作過(guò)程應(yīng)在無(wú)菌條件下進(jìn)行,使用新的離心管、移液槍頭,并經(jīng)高壓滅菌處理。所有試劑都要滅菌,并注意防止被其他試劑、DNA酶或雜DNA所污染,否則會(huì)影響轉(zhuǎn)化效率或雜DNA的轉(zhuǎn)入。
5. 操作需在冰上進(jìn)行,不能離開(kāi)冰浴,否則細(xì)胞轉(zhuǎn)化率將會(huì)降低。
06
注意事項(xiàng)
1. 為確保高效轉(zhuǎn)化,細(xì)胞活力應(yīng)保持在每毫升10^8個(gè)細(xì)胞以下,對(duì)于大多數(shù)散大腸桿菌而言,相應(yīng)的光學(xué)密度(OD值)約為0.4左右。為避免細(xì)菌培養(yǎng)物的生長(zhǎng)密度過(guò)高,建議每15-20分鐘測(cè)定一次OD600值以進(jìn)行監(jiān)測(cè)。通過(guò)記錄監(jiān)測(cè)時(shí)間和OD值,可制作一個(gè)圖表來(lái)預(yù)測(cè)培養(yǎng)物達(dá)到OD600值0.4所需的時(shí)間。當(dāng)OD600值達(dá)到0.35時(shí),即可收獲細(xì)菌培養(yǎng)物。
2. 不同生長(zhǎng)階段的菌株間,OD值與每毫升中活細(xì)胞數(shù)量存在顯著變化。為了標(biāo)準(zhǔn)化,需測(cè)量特定大腸桿菌菌株在其生長(zhǎng)周期中不同時(shí)間點(diǎn)的OD600值,并將每個(gè)稀釋度的培養(yǎng)物均勻涂布在不含抗生素的LB瓊脂板上,以計(jì)算每個(gè)時(shí)期的活細(xì)胞數(shù)量,以確保分光光度計(jì)的讀數(shù)標(biāo)準(zhǔn)化。
3. 大多數(shù)大腸桿菌(除了MC106)在轉(zhuǎn)化中使用TFB替代CaCl2可以獲得相同或更好的結(jié)果。根據(jù)1979年Dagert和Ehrlieh的實(shí)驗(yàn),細(xì)胞在4℃條件下可在CaCl2溶液中保存24-48小時(shí)。在最初12-24小時(shí)的儲(chǔ)存過(guò)程中,轉(zhuǎn)化率增加了4-6倍,然后逐漸降低至初始水平。
4. 選擇新鮮平板的單克隆以確保克隆的新鮮程度,即剛涂布生長(zhǎng)過(guò)夜的平板。
5. 菌體的OD600值對(duì)轉(zhuǎn)化效率有影響,JM109或BL21的OD值為0.35,DH5α為0.4,應(yīng)盡量避免過(guò)高的OD值,不得超過(guò)0.6。
6. 在低溫處理后,應(yīng)在冰上保存12-24小時(shí)后分裝,并冷凍保存于-80℃。
7. 所有用品(如離心管、藥瓶等)應(yīng)使用新的,若使用舊的,則必須確保其干凈,并準(zhǔn)備好CaCl2溶液。
來(lái)源:“ 譽(yù)嘉醫(yī)學(xué)”公眾號(hào)


