細胞凍存時一切正常,復蘇后為啥“涼涼”?
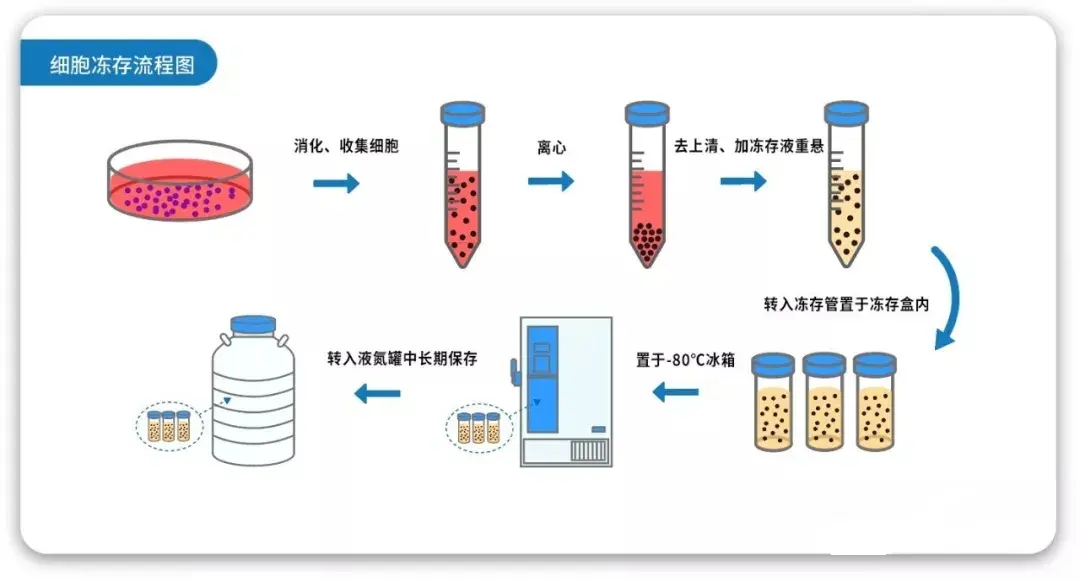
細胞凍存是細胞生物學研究中的關鍵技術,它通過將細胞置于低溫環境中,減緩細胞代謝,從而實現細胞的長期保存。然而,許多科研人員在實際操作中發現,明明凍存時細胞狀態良好,但復蘇后細胞卻大量死亡,這不僅浪費了時間和資源,還可能影響實驗進度。那么,問題究竟出在哪里呢?

一、細胞凍存的關鍵步驟與常見誤區
凍存液的選擇:凍存液是細胞凍存過程中不可或缺的保護劑,其主要成分包括DMSO(二甲基亞砜)和血清。DMSO能夠滲透細胞,降低冰點,減少冰晶的形成,從而保護細胞。然而,DMSO濃度過高會對細胞產生毒性,因此通常需要與血清等成分混合使用,以提高細胞的耐受性。選擇合適的凍存液至關重要,不同的細胞類型可能對凍存液的成分有不同的要求,因此在凍存前需要根據細胞特性進行優化。
細胞狀態的評估:在進行細胞凍存之前,必須對細胞狀態進行全面評估。細胞密度、活力和形態是評估細胞狀態的關鍵指標。細胞密度應控制在適當的范圍內,通常建議細胞密度在1-5×10^6個/ml之間。細胞活力可以通過臺盼藍染色等方法檢測,確保細胞活力在90%以上。如果細胞狀態不佳(如細胞老化、污染或活力不足),強行凍存會導致細胞在復蘇后大量死亡。
降溫速率的控制:降溫速率是細胞凍存過程中的關鍵因素。過快或過慢的降溫速率都會對細胞造成損傷。理想的降溫速率是-1℃/min。緩慢降溫可以使細胞有足夠的時間通過滲透作用排出水分,減少冰晶的形成。如果降溫過快,細胞內外的水分會迅速結冰,導致細胞膜和細胞器的損傷。因此,在凍存過程中,建議使用程序降溫盒或梯度降溫法,確保細胞在降溫過程中受到的損傷最小。
二、細胞復蘇的正確操作與注意事項
復蘇溫度與時間:細胞復蘇的核心原則是“快融”,即快速將凍存的細胞解凍。從液氮罐中取出凍存管后,應立即放入37℃水浴鍋中,輕柔搖晃凍存管,確保受熱均勻。整個解凍過程應在1-2分鐘內完成。如果解凍時間過長,細胞會受到熱損傷,導致細胞死亡率增加。
離心與重懸的技巧:解凍后的細胞需要進行離心處理,以去除凍存液中的DMSO。通常建議以200g的離心力離心10分鐘。在離心過程中,應注意避免劇烈震蕩,以免對細胞造成機械損傷。離心后,用移液器小心去除上清液,避免擾動細胞沉淀。然后,將細胞沉淀重懸于適量的預熱培養基中。
培養基的預熱與添加:復蘇后的細胞需要立即轉移到預熱的培養基中,以減少冷沖擊對細胞的損傷。培養基的溫度應控制在37℃左右。將細胞重懸于培養基后,轉移到細胞培養瓶或培養皿中,并放入二氧化碳培養箱中培養。在細胞貼壁后,需要更換新鮮培養基,以去除殘留的DMSO和死細胞。

三、凍存與復蘇過程中的環境因素
凍存環境的穩定性
液氮罐的維護和檢查:液氮罐是細胞凍存的關鍵設備,其穩定性直接影響細胞的存活率。液氮罐需要定期檢查,確保液氮水平充足,避免液氮泄漏或干涸。建議每周檢查液氮罐的液氮水平,并及時補充。同時,檢查液氮罐的密封性,確保沒有泄漏。液氮罐的溫度應保持在-196℃左右,任何溫度波動都可能導致細胞損傷。
液氮泄漏或溫度波動對細胞的影響:液氮泄漏會導致溫度升高,細胞在短時間內暴露在較高溫度下,可能會導致細胞膜和細胞器的損傷,甚至細胞死亡。此外,液氮罐內的溫度不均勻也可能導致細胞凍存效果不佳。因此,定期維護液氮罐,確保其穩定運行,是細胞凍存成功的關鍵。
復蘇環境的準備
實驗室環境的準備:復蘇前,實驗室環境的準備至關重要。首先,確保超凈臺的清潔和消毒,使用75%酒精擦拭工作臺面,并開啟紫外燈消毒30分鐘。其次,預熱培養箱至37℃,并確保培養箱內的二氧化碳濃度穩定在5%左右。此外,準備好預熱的培養基和離心機,確保所有設備和試劑都處于最佳狀態。
環境因素對細胞復蘇成功率的影響:復蘇環境的穩定性直接影響細胞的存活率。如果復蘇后的細胞暴露在不穩定的環境中,可能會導致細胞應激反應,甚至死亡。因此,確保實驗室環境的清潔和設備的預熱,可以顯著提高細胞復蘇的成功率。
四、細胞凍存與復蘇的優化建議
凍存前的細胞預處理
添加保護劑:在凍存前,可以通過添加保護劑來提高細胞的耐受性。常用的保護劑包括胎牛血清(FBS)、白蛋白和甘油等。這些保護劑可以減少冰晶的形成,降低細胞在凍存過程中的損傷。例如,添加10%的胎牛血清可以顯著提高細胞的存活率。
實驗室優化凍存條件的經驗:
細胞密度優化:建議細胞密度控制在1-5×10^6個/ml之間。過高的細胞密度會導致細胞聚集,影響凍存效果。
預凍處理:在凍存前,可以將細胞置于4℃冰箱中預凍30分鐘,以減少細胞的應激反應。
凍存液的優化:根據細胞類型選擇合適的凍存液配方。例如,對于一些對DMSO敏感的細胞,可以嘗試使用低濃度DMSO(5%)的凍存液。
復蘇后的細胞觀察與調整
細胞狀態的觀察:復蘇后,立即觀察細胞的形態和活力。使用顯微鏡檢查細胞是否貼壁,細胞形態是否正常。可以使用臺盼藍染色檢測細胞活力,確保細胞存活率在80%以上。如果細胞狀態不佳,如出現大量死細胞或細胞形態異常,需要及時調整培養條件。
調整培養條件:
更換培養基:復蘇后的細胞需要在貼壁后更換新鮮培養基,以去除殘留的DMSO和死細胞。
調整培養條件:根據細胞狀態調整培養條件,如增加血清濃度或添加生長因子,以促進細胞恢復。
觀察細胞生長:在復蘇后的24-48小時內,密切觀察細胞的生長情況。如果細胞生長緩慢或出現異常,可以考慮調整培養條件或進行再次復蘇。
五、常見問題解答與案例分享
常見問題解答
細胞結團:
原因:細胞在凍存過程中密度較高,導致細胞聚集。
解決方案:在凍存前將細胞密度控制在適當范圍內(1-5×10^6個/ml),并確保凍存液中添加足夠的保護劑。
復蘇后死亡率高:
原因:可能是因為凍存液選擇不當、降溫速率不正確、復蘇溫度過高或過低、復蘇后未及時更換培養基等。
解決方案:優化凍存液配方,控制降溫速率,確保復蘇溫度在37℃,并在復蘇后立即更換預熱的培養基。
細胞形態異常:
原因:可能是因為細胞在凍存過程中受到損傷,或復蘇后培養條件不當。
解決方案:在凍存前對細胞狀態進行嚴格評估,確保細胞活力在90%以上。復蘇后根據細胞狀態調整培養條件,如增加血清濃度或添加生長因子。
成功案例分享
案例一:某實驗室的優化經驗
背景:某實驗室在進行細胞凍存與復蘇時,發現復蘇后細胞死亡率較高。
優化措施:
凍存液優化:將DMSO濃度從10%降低到5%,并添加10%胎牛血清。
降溫速率控制:使用程序降溫盒,確保降溫速率為-1℃/min。
復蘇操作優化:確保復蘇溫度為37℃,并在復蘇后立即更換預熱的培養基。
結果:經過優化后,細胞復蘇后的存活率從60%提高到90%以上。
案例二:某研究團隊的凍存與復蘇經驗
背景:某研究團隊在進行細胞凍存與復蘇時,發現細胞復蘇后生長緩慢。
優化措施:
細胞預處理:在凍存前將細胞置于4℃冰箱中預凍30分鐘。
培養條件調整:在復蘇后增加血清濃度至20%,并添加適量的生長因子。
結果:經過優化后,細胞復蘇后的生長速度顯著提高,細胞形態正常。
細胞凍存與復蘇是細胞生物學研究中的重要技術,但操作不當會導致細胞死亡率增加。通過優化凍存液配方、控制降溫速率、確保復蘇環境穩定以及根據細胞狀態調整培養條件,可以顯著提高細胞的存活率。希望這些實用的操作技巧和成功案例能夠幫助科研人員更好地進行細胞凍存與復蘇實驗。


