氧化還原滴定法
第三節(jié) 氧化還原滴定法
一、概述
氧化還原滴定法是以氧化還原反應(yīng)為基礎(chǔ)的滴定分析方法。氧化還原反應(yīng)較為復(fù)雜,一般反應(yīng)速度較慢,副反應(yīng)較多,所以并不是所有的氧化還原反應(yīng)都能用于滴定反應(yīng),應(yīng)該符合滴定分析的一般要求,即反應(yīng)完全,反應(yīng)速度快;無副反應(yīng)等。因此,必須根據(jù)具體情況,創(chuàng)造適宜的反應(yīng)條件。
(1)根據(jù)平衡常數(shù)的大小判斷反應(yīng)進(jìn)行程度。一般K≥106或 時(shí),該反應(yīng)進(jìn)行得完全。
(2)反應(yīng)速度快。一般可通過下列幾種方法增加反應(yīng)速度。
①加催化劑。例如,用MnO-4氧化Fe2+時(shí),加入少許Mn2+作為催化劑,可使反應(yīng)迅速進(jìn)行。
②升高溫度。例如,用MnO-4氧化C2O2-4時(shí),室溫下反應(yīng)進(jìn)行得很慢,溫度升高到80℃時(shí)反應(yīng)能夠很快地進(jìn)行。
(3)無副反應(yīng)。若用于滴定分析的氧化還原反應(yīng)伴有副反應(yīng)發(fā)生,必須設(shè)法消除。如果沒有抑制副反應(yīng)的方法,反應(yīng)就不能用于滴定。
按照氧化還原滴定中所用氧化劑的不同,將氧化還原法分為高錳酸鉀法、碘量法、重鉻酸鉀法等。本節(jié)主要討論高錳酸鉀法和碘量法。
二、高錳酸鉀法
(一)基本原理
在微酸、中性或弱堿性溶液中,MnO - 4 被還原為棕色不溶物MnO 2 :
因MnO2能使溶液混濁,妨礙疑點(diǎn)觀察,所以高錳酸鉀法通常在較強(qiáng)的酸性溶液中進(jìn)行。滴定時(shí)使用H2SO4控制酸度,避免使用HNO3(有氧化性)和HCL(有還原性)。
KMnO4還原為Mn2+的反應(yīng)在常溫下進(jìn)行得較慢。因此,滴定較難氧化的物質(zhì)時(shí),常需要加熱或加催化劑。例如,用KMnO4滴定C2O2-4時(shí),即使在強(qiáng)酸性溶液中加熱的情況下,開始時(shí)反應(yīng)也不會(huì)迅速進(jìn)行。只有待最初加入的1-2滴KMnO4溶液的紫色退去后,溶液中就有了Mn2+,接著的反應(yīng)能較快地進(jìn)行。這種由于反應(yīng)生成物本身引起的催化作用稱為自動(dòng)催化作用。
高錳酸鉀法的指示劑是KMnO4本身,在100ml水中只要加1滴0.1mol?L-1KMnO4溶液就可以呈現(xiàn)明顯的紫紅色.而它的還原產(chǎn)物Mn2+則近無色.所以高錳酸鉀法不需另加指示劑。
KMnO4氧化性強(qiáng),在強(qiáng)酸性溶液中可直接滴定一些還原性物質(zhì),如Fe2+,AsO3-3,NO-2,Sb3+,H2O2,C2O2-4,甲醛,葡萄糖和水楊酸等;也可間接滴定一些氧化性物質(zhì),如MnO2,PbO2,CrO-3,CLO-3等;還可測(cè)定一些能與氧化劑或還原劑起反應(yīng),但無氧化性或還原性的物質(zhì),如Ca2+,Ba2+,Zn2+和Cd2+等。例如,Ca2+能與C2O2-4形成沉淀溶于H2SO4中,然后用KmnO4溶液滴定生成H2C2O4,從而測(cè)出Ca2+的含量。
高錳酸鉀法的主要缺點(diǎn)是選擇性較差,標(biāo)準(zhǔn)溶液不夠穩(wěn)定等。
(二)高錳酸鉀的應(yīng)用示例――市售過氧化氫中H2O2含量的測(cè)定
在酸性溶液中,H 2 O 2 被KmnO 4 氧化。
2MnO - 4 +5H 2 O 2 +6H + →2Mn 2 +5O 2 +8H 2 o
氧化還原滴定同樣也要經(jīng)過標(biāo)準(zhǔn)溶液的配制、標(biāo)定和被測(cè)物質(zhì)含量測(cè)定三個(gè)過程:
1.KMnO4標(biāo)準(zhǔn)溶液的配制
稱取約0.86g KMnO4加蒸餾水配成500ml0.01mol?L-1的標(biāo)準(zhǔn)溶液。加熱至沸,并保持微沸約1h。冷卻,放暗處約一周后用垂熔玻璃漏斗或玻璃絲過濾。將濾液移至棕色瓶?jī)?nèi)暗處保存。
2.KMnO4溶液濃度的標(biāo)定
可用基準(zhǔn)物質(zhì)Na2CO3標(biāo)定KMnO4溶液的濃度,反應(yīng)式如下:
3.過氧化氫含量的測(cè)定
用移液管吸取市售過氧化氫1.00ml,放入250ml容量瓶中,稀釋25.00ml于錐形瓶中,加6ml3mol?L-1H2SO4,用KMnO4標(biāo)準(zhǔn)溶液滴定溶液呈粉紅色,設(shè)稀釋后H2O2的密度為1,H2O2的含量可按下式計(jì)算:
三、碘量法
(一)基本原理
碘量法是利用I2的氧化性和I-的還原性進(jìn)行滴定的分析方法。
I 2 +2e -2I -=0.535V
從值可知,I2是一種較弱的氧化劑,而I-是中等 強(qiáng)度的還原劑 。低于
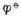
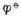 電對(duì)的還原性物質(zhì)如S2-,SO2-3,AsO3-3,SbO3-3,維生素C等,能用I2標(biāo)準(zhǔn)溶液直接滴定,這種方法叫直接碘量法或碘滴定法。高于
電對(duì)的還原性物質(zhì)如S2-,SO2-3,AsO3-3,SbO3-3,維生素C等,能用I2標(biāo)準(zhǔn)溶液直接滴定,這種方法叫直接碘量法或碘滴定法。高于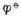 電對(duì)的氧化性物質(zhì)如Cu2+,Cr2O2-7,CrO2-4,MnO2-4,NO-2,CL2,H2O2,漂白粉等,可將I-氧化成I2,再用Na2S2O3標(biāo)準(zhǔn)溶液滴定生成的I2。這種滴定方法叫間接碘量法或滴定碘量法。
電對(duì)的氧化性物質(zhì)如Cu2+,Cr2O2-7,CrO2-4,MnO2-4,NO-2,CL2,H2O2,漂白粉等,可將I-氧化成I2,再用Na2S2O3標(biāo)準(zhǔn)溶液滴定生成的I2。這種滴定方法叫間接碘量法或滴定碘量法。
1.直接碘量法
用直接碘量法來測(cè)定還原性物質(zhì)時(shí),一般應(yīng)在弱堿性、中性或弱酸性溶液中進(jìn)行,如測(cè)定AsO3-3需在弱堿性NaHCO3溶液中進(jìn)行。
若反應(yīng)在強(qiáng)酸性溶液中進(jìn)行,則平衡向左移動(dòng),且I-易被空氣中的O2氧化:
4I - +O 2 +4H + →2I 2 +2H 2 O
如果溶液的堿性太強(qiáng),I 2 就會(huì)發(fā)生歧化反應(yīng):
I 2 標(biāo)準(zhǔn)溶液可用升華法制得的純碘直接配制。但I(xiàn) 2 具有揮發(fā)性和腐蝕性,不宜在 天平 上稱量,故通常先配成近似濃度的溶液,然后進(jìn)行標(biāo)定。由于碘在水中的溶解度很小,通常在配制I 2 溶液時(shí)加入過量的KI以增加其溶解度,降低I 2 的揮發(fā)性。直接碘量法可利用碘自身的黃色或加淀粉作指示劑,I 2 遇淀粉呈藍(lán)色。
2.間接碘量法
間接碘量法測(cè)定氧化性物質(zhì)時(shí),須在中性或弱酸性溶液中進(jìn)行。例如,測(cè)定K 2 Cr 2 O 7 含量的反應(yīng)如下:
Cr 2 O 7 2- +6I - +14H + →2Cr 3 +3I 2 +7H 2 O
I 2 +2S 2 O 2 2- →2I - +S 4 O 2- 6
若溶液為堿性,則存在如下事反應(yīng):
I 2 +S 2 O 2 2- +10OH -
北京天優(yōu)福康生物科技有限公司
官網(wǎng):http://www.jyzjsd.com/
服務(wù)熱線:400-860-6160
聯(lián)系電話/微信:13718308763
QQ:2136615612 3317607072
E-mail:Tianyoubzwz@163.com


